| Propiedades de los alcoholes |
| Los alcoholes son compuestos que presentan en la cadena carbonada uno o más grupos hidroxi u oxidrilo (-OH). |  |
Propiedades Físicas: |
 | Las propiedades físicas de un alcohol se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma. |
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras. |
|
Solubilidad:
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol. |
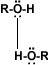
alcohol-alcohol |
|
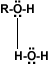
alcohol-agua |
|
A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos. |
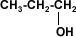
1 propanol |
|
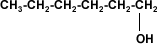
Hexanol |
|
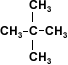
2-metil-2-propanol |
| Existen alcoholes de cuatro átomos de carbono que son solubles en agua, debido a la disposición espacial de la molécula. Se trata de moléculas simétricas. |
Existen alcoholes con múltiples moléculas de OH (polihidroxilados) que poseen mayor superficie para formar puentes de hidrógeno, lo que permiten que sean bastante solubles en agua. |
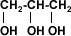
1,2,3 propanotriol (glicerina) |
|
| Punto de Ebullición: Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones. |
| El punto de fusión aumenta a medida que aumenta la cantidad de carbonos. |
|
Densidad: La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones. Es así que los alcoholes alifáticos son menos densos que el agua mientras que los alcoholes aromáticos y los alcoholes con múltiples moléculas de –OH, denominados polioles, son más densos.
(Constantes Físicas de algunos alcoholes)
|
| Nombre | Punto de fusiónºC | Punto de ebullición ºC | Densidad |
| Metanol | -97,5 | 64,5 | 0,793 |
| 1-propanol | -126 | 97,8 | 0,804 |
| 2-propanol | -86 | 82,3 | 0,789 |
| 1-butanol | -90 | 117 | 0,810 |
| 2-butanol | -114 | 99,5 | 0,806 |
| 2-metil-1-propanol | -108 | 107,3 | 0,802 |
| 2-metil-2-propanol | 25,5 | 82,8 | 0,789 |
| 1-pentanol | -78,5 | 138 | 0,817 |
| Ciclohexanol | 24 | 161,5 | 0,962 |
| |
|
|
|
Propiedades Químicas: |
| Los alcoholes pueden comportarse como ácidos o bases, esto gracias al efecto inductivo, que no es más que el efecto que ejerce la molécula de –OH como sustituyente sobre los carbonos adyacentes. Gracias a este efecto se establece un dipolo. |
La estructura del alcohol está relacionada con su acidez. Los alcoholes, según su estructura pueden clasificarse como metanol, el cual presenta un sólo carbono, alcoholes primarios, secundarios y terciarios que presentan dos o más moléculas de carbono. |
| Alcohol Terciario | 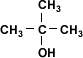 | 2-metil-2-propanol |
| Alcohol Secundario | 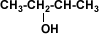 | 2-butanol |
| Alcohol Primario | 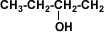 | 1-butanol |
| Metanol | 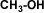 | |
|
| Metanol > alcohol primario > alcohol secundario > alcohol terciario(>: mayor acidez) |
|
Debido a que en el metanol y en los alcoholes primarios el hidrógeno está menos firmemente unido al oxígeno, la salida de los protones de la molécula es más fácil por lo que la acidez será mayor en el metanol y el alcohol primario. |
Deshidratación: la deshidratación de los alcoholes se considera una reacción de eliminación, donde el alcohol pierde su grupo –OH para dar origen a un alqueno. Aquí se pone de manifiesto el carácter básico de los alcoholes. La reacción ocurre en presencia de ácido sulfúrico (H2SO4) en presencia de calor. |
|
|
La deshidratación es posible ya que el alcohol acepta un protón del ácido, para formar el alcohol protonado o ión alquil hidronio. |
El alcohol protonado pierde una molécula de agua y forma un ión alquil-carbonio: |
|
|
El ión alquil-carbonio pierde un protón lo que regenera la molécula de ácido sulfúrico y se establece el doble enlace de la molécula a la cual está dando origen el alcohol. |
El calentamiento de un alcohol en presencia de ácido sulfúrico a temperaturas inferiores a las necesarias para obtener alquenos producirá otros compuestos como éteres y ésteres. |
Obtención de alcoholes: al igual que a partir de los alcoholes se pueden obtener otros compuestos, los alcoholes pueden ser obtenidos a partir de hidratación o hidroboración – oxidación de alquenos, o mediante hidrólisis de halogenuros de alquilo. Para la obtención de alcoholes por hidratación de alquenos se utiliza el ácido sulfúrico y el calor. |
|
| La hidroboración: (adición de borano R3B) de alqueno en presencia de peróxido de hidrógeno (H2O2) en medio alcalino da origen a un alcohol. |
|
|
La hidrólisis: de halogenuros de alquilo o aralquilo se produce en presencia de agua y hidróxidos fuertes que reaccionan para formar alcoholes. |
|
En la industria la producción de alcoholes se realiza a través de diversas reacciones como las ya mencionadas, sin embargo se busca que éstas sean rentables para proporcionar la máxima cantidad de producto al menor costo. Entre las técnicas utilizadas por la industria para la producción de alcoholes se encuentra la fermentación donde la producción de ácido butírico a partir de compuestos azucarados por acción de bacterias como el Clostridium butycum dan origen al butanol e isopropanol. Para la producción de alcoholes superiores en la industria la fermentación permite la producción de alcoholes isoamílico, isobutílico y n-propílico a partir de aminoácidos. Es así como la industria utiliza los procesos metabólicos de ciertas bacterias para producir alcoholes.
| usos: |
Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla.
| Beneficios para la salud: |
| Supongo que, de algún modo, directa o indirectamente, algunos de nosotros conocemos algunos efectos, directos e indirectos, a su vez, de haber abusado del alcohol en alguna ocasión (celebraciones, fin de año, etc), gracias a que esa información se encuentra hoy en día a nuestro alcance. Es decir, estamos cada vez mejor informados acerca de sus propiedades y consecuencias para la Salud, el Trabajo y la Familia. |
|
Ya sean motivados por intereses financieros o socio-políticos, Estudios de Centros de investigación de diversas Universidades, Congresos y Revistas científicas, además de especialistas en Salud y Nutrición, nos confirman las propiedades positivas de un consumo moderado de determinadas bebidas alcohólicas, como son el caso del vino y la cerveza.
|
Por consenso, se considera que un consumo moderado de bebidas alcohólicas, teniendo en cuenta que la misma cantidad de alcohol afecta de forma diferente a cada persona según sus características genéticas y medioambientales, en hombres se recomienda solo dos copas por día y en mujeres únicamente una, acompañando siempre a la comida.
Riesgos para la salud :
Metanol
Entre los muchos procesos de síntesis que existen para la producción de alcohol metílico se encuentra la reacción de FischerTropsch entre el monóxido de carbono y el hidrógeno, de la que se obtiene metanol como subproducto. También se produce mediante la oxidación directa de hidrocarburos o mediante un proceso de hidrogenación en dos etapas en el que se hidrogena el monóxido de carbono para dar formiato de metilo, que a su vez se hidrogena para obtener alcohol metílico. Sin embargo, la síntesis más importante es la realizada mediante hidrogenación catalítica a presión del monóxido de carbono o del dióxido de carbono, a presiones de 100-600 kgf/cm2 y temperaturas de 250-400 ºC.
|
|
Etanol
Un riesgo industrial frecuente es la exposición a vapores en la proximidad de un proceso en el que se utiliza alcohol etílico. La exposición prolongada a concentraciones superiores a 5.000 ppm causa irritación de los ojos y la nariz, cefalea, sopor, fatiga y narcosis. El alcohol etílico se oxida muy rápidamente en el organismo a dióxido de carbono y agua. El alcohol no oxidado se excreta en la orina y en el aire espirado, de manera que apenas se producen efectos acumulativos. Su efecto en la piel es similar al de todos los disolventes de grasas y, de no tomarse las debidas precauciones, puede producirse una dermatitis de contacto.
|
n-Propanol
No se han notificado casos de intoxicación relacionados con el uso industrial de n-propanol. Para los animales de experimentación es moderadamente tóxico cuando se administra por vías respiratoria, oral o percutánea. Irrita las mucosas y deprime el sistema nervioso central. Cuando se inhala, produce una leve irritación del aparato respiratorio y ataxia. Es algo más tóxico que el alcohol isopropílico, pero aparentemente provoca los mismos efectos biológicos. Se conoce un caso de fallecimiento por ingestión de 400 ml de n-propanol. Los cambios morfopatológicos observados fueron principalmente edema cerebral y pulmonar, también presentes con frecuencia en la intoxicación etílica. El n-propanol es inflamable y representa un riesgo moderado de incendio.
Principales compuestos de los alcoholes:
|
METANOL
CH3-OH
En un principio se obtenía a partir de la destilación seca de la madera por eso se la conoce como alcohol de madera. Tiene importantes aplicaciones como disolventes y materia prima para la fabricación de formaldehído y otros compuestos. Es muy tóxico la inhalación de sus vapores y su ingestión produce ceguera e incluso la muerte. El METANOL, según los "expertos", es mucho mas viable a corto plazo que el hidrógeno, actualmente, es un 75% menos contaminante que la gasolina, incluyendo los procesos de obtención del mismo.
Alcohol isopropilico
(2-propanol)
Es un antiséptico más eficaz que el alcohol etílico. Se usa en la industria para la elaboración de acetona. Se usa en la limpieza de aparatos electrónicos, como cabezas de videocasetes o de grabadoras.
|
Etanol
(alcohol de caña) CH3-CH2-OH.
Se obtiene por fermentación al añadir levadura a los azucares presentes en algunos alimentos, como la cebada, centeno, uva, arroz, caña y agave azul de donde se hace tequila (mezcal). Se utiliza como disolvente en la preparación de muchos productos farmacéuticos. También sirve como medicamento, desinfectante, además es utilizado en perfumería y como combustible. Un gran volumen de este producto se consume en forma de bebidas embriagantes.
Bibliografia: |
- http://html.rincondelvago.com/alcoholes_3.html
- http://es.scribd.com/doc/21948813/14/Aplicaciones-de-los-alcoholes
- http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_alcoholes.htm
|
|
|
|
|
|
|
|
|
|